 病因
病因
病因:大多数散发性甲状腺肿患者没有明显的病因,部分患者的发病可能与下列因素有关:
1.碘缺乏 儿童阶段曾有轻度碘缺乏,到了成人阶段,即使碘摄入已恢复正常,仍可引起甲状
腺病变的继续发展。
2.酶缺陷 甲状腺激素合成过程中某些酶的先天性缺陷或获得性缺陷可引起散发性甲状腺肿,如碘化物运输酶缺陷、过氧化物酶缺陷、去卤化酶缺陷、碘酪氨酸耦联缺陷等。
3.药物 碘化物、氟化物、锂盐、氨基比林、氨鲁米特、磺胺类、保泰松、胺碘酮、磺胺丁脲、丙硫氧嘧啶等药物可引起散发性甲状腺肿。毒性甲状腺肿孕妇服用丙硫氧嘧啶治疗,丙硫氧嘧啶虽不能透过胎盘屏障,但母体血T4、T3水平下降,使胎儿血T4、T3水平也随之下降,刺激胎儿TSH水平上升,可发生先天性甲状腺肿。
4.吸烟 吸烟可引起散发性甲状腺肿,因为吸入物中含硫氰酸盐,这是一种致甲状腺肿物质,吸烟者血清甲状腺球蛋白水平要高于非吸烟者。
5.遗传因素 Brix(1999)曾对非
地方性甲状腺肿流行地区的5000多例单卵双生和双卵双生的同性别孪生子进行研究,发现
单纯性甲状腺肿的遗传易感性占82%,只有18%归因于环境因素,该研究结果是散发性甲状腺肿可由遗传因素引起的重要证据。目前发现与散发性甲状腺肿发病有关的遗传因素有14q、多
结节性甲状腺肿基因-1、3q26、Xp22、甲状腺球蛋白基因等。
6.甲状腺素需要量增加 在青春发育期或妊娠期,机体对于甲状腺激素的需要量增加,甲状腺激素的合成相对不足,可发生
单纯性甲状腺肿。
7.其他疾病 皮质醇增多症、
肢端肥大症及终末期肾脏疾病患者可发生散发性甲状腺肿。
 发病机制
发病机制
发病机制:
1.发病机制 散发性甲状腺肿的发病机制目前尚无定论,可能有多种因素、多种机制参与作用。
(1)TSH的刺激:部分散发性甲状腺肿患者存在碘摄入不足或摄入致甲状腺肿药物,甲状腺激素合成下降,反馈性刺激垂体分泌TSH增加,TSH刺激甲状腺细胞增生肥大,这部分患者补充碘剂或甲状腺素可抑制TSH。
(2)甲状腺对TSH的敏感性增加:多数散发性甲状腺肿患者血清T3、T4水平正常,血清TSH水平正常,合理的解释是部分亚群的甲状腺滤泡细胞对TSH刺激的敏感性增加,对于这部分病人补充碘剂或甲状腺素不能抑制TSH。
(3)TSH类似物质:有相当一部分散发性甲状腺肿病人体内可检测到甲状腺生长刺激抗体(growth-stimulating Abs)、甲状腺刺激多肽(thyroid-stimulating peptides),这些物质有类似TSH的作用,但不依赖TSH受体。
(4)生长因子:在散发性甲状腺肿的发生过程中,甲状腺内分泌、甲状腺外旁分泌一些生长因子可能参与作用。
①胰岛素样生长因子-1(IGF-1):Minuto(1989)发现散发性甲状腺肿病人体内有免疫反应性的IGF-1水平比正常人群升高2倍,而在Graves病病人体内未升高。Maiorano(1994)研究发现散发性甲状腺肿病人IGF-1水平升高主要位于甲状腺滤泡细胞。体外细胞培养研究表明甲状腺滤泡细胞能分泌IGF-1,但不依赖外源性IGF-1,说明在甲状腺增生性疾病中有自分泌IGF-I现象。体外及体内研究还表明IGF-1与TSH协同刺激甲状腺生长及正常发挥功能,两者缺一不可。甲状腺自分泌IGF-1的调节与碘有关,缺碘时,甲状腺滤泡细胞自分泌IGF-1增加。
②成纤维细胞生长因子(FGF):Thompson(1998)研究发现散发性甲状腺肿滤泡细胞表达FGF-1、FGF-2及FGFR-1,且表达水平高于正常甲状腺组织。动物实验显示,FGF-1可以使甲状腺重量明显增加,使脱碘酶的活性降低。
③转化生长因子-β(TGF-β):体外细胞培养研究发现TGF-β对甲状腺滤泡细胞的生长表现为抑制作用,但甲状腺滤泡细胞分泌的TGF-β1可以加强滤泡周围成纤维细胞的增生,使滤泡周围间质扩展,从而导致散发性甲状腺肿组织中常见的纤维变性和基质的过度沉积。
④表皮生长因子(EGF):体外细胞培养实验表明,EGF可刺激甲状腺滤泡细胞的增生,TSH可以加强EGF与甲状腺细胞表面的EGF-R结合,同时可加强EGF对甲状腺细胞的有丝分裂。
⑤血管生成因子:甲状腺滤泡上皮增生需要血管床的增生,以维持营养供应。因此,在散发性甲状腺肿发生过程中有血管生成因子参与作用。甲状腺滤泡细胞可通过旁分泌FGF,刺激内皮细胞增生。体外实验表明TSH可刺激甲状腺细胞分泌血管内皮生长因子(VEGF)增加,从而促进内皮细胞增生。
⑥内皮素(endothelin,ET):ET-1主要由血管内皮合成,ET-2、ET-3主要由血管平滑肌细胞合成。ET的受体有ETA和ETB。ETA在血管平滑肌细胞上表达,参与血管收缩。ETB在血管内皮细胞上表达,参与一氧化氮(NO)、前列腺环素和利尿钠多肽(natriurotic peptide,ANP)的生成的作用。一氧化氮合成酶基因(NOS I,NOSⅢ)表达水平可上升,如加入NOS抑制物,可降低血管的增生。体外实验显示ANP可以抑制甲状腺细胞释放甲状腺球蛋白,而TSH可以下调甲状腺细胞ANP受体的数目。另外,ET-1和ANP都可以调节内皮细胞VEGF的合成,ET-1刺激VEGF的合成,ANP则抑制VEGF的合成。因此,在甲状腺肿的发生过程中,VEGF、ET-1、ANP相互作用,共同调节血管生成。
⑦肝细胞生长因子(HGF):甲状腺细胞可以分泌HGF,而HGF是甲状腺细胞强烈的有丝分裂原。
在
地方性甲状腺肿的发病机制中,缺碘引起的TSH水平的升高起着关键作用,而对于散发性甲状腺肿,血清TSH水平一般不升高,TSH与多种生长因子相互作用,从而决定散发性甲状腺肿的发生、发展。细胞内碘水平较低可能是散发性甲状腺肿的结果,而非诱因。
(5)自身免疫 散发性甲状腺肿组织可表达HLA-DR抗原,表达HLA-DR抗原的上皮细胞可以自身递呈抗原,激发自身免疫反应,产生自身抗体,这些自身抗体具有刺激甲状腺细胞生长的作用。
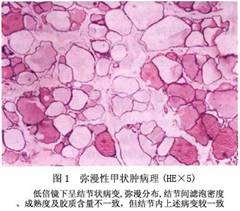
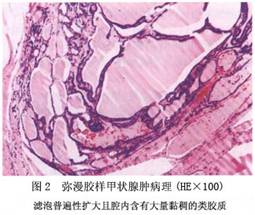
2.病理 本病的组织学改变视病因及病期有一定差异。在早期,甲状腺呈弥漫性轻度或中度增生肿大,血管增多、腺细胞肥大。当疾病持续或反复恶化及缓解时,甲状腺因不规则增生或再生,逐渐出现结节。随病情发展,由于腺泡内积聚大量胶质(胶性甲状腺肿),形成巨大腺泡,滤泡上皮细胞呈扁平,腺泡间结缔组织和血管减少。至后期,部分腺体可发生坏死、出血、囊性变、纤维化或钙化,此时甲状腺不仅体积显著增大,且有大小不等,质地不一的结节。甲状腺结构和功能的异质性,一定程度功能上的自主性是本病后期的特征(图1,图2)。
 临床表现
临床表现
临床表现:
1.甲状腺肿大或颈部肿块 甲状腺肿大是
非毒性甲状腺肿特征性的临床表现,患者常主诉颈部变粗或衣领发紧。甲状腺位于颈前部,易向外生长,有时甲状腺肿可向下发展进入胸骨后,这可能是由于胸廓内负压所致;偶见甲状腺肿发生于迷走甲状腺组织。病程早期为弥漫性甲状腺肿大,查体可见肿大甲状腺表面光滑,质软,随吞咽上下活动,无震颤及血管杂音,青春期、妊娠期、哺乳期患者甲状腺肿大明显加重。随着病程的发展,逐渐出现甲状腺结节性肿大,一般为不对称性、多结节性,多个结节可聚集在一起,表现为颈部肿块。结节大小不等、质地不等、位置不一。甲状腺肿一般无疼痛,如有结节内出血则可出现疼痛。如体检发现甲状腺结节质硬,活动度欠佳,应警惕恶变可能。
2.压迫症状 压迫症状是
非毒性甲状腺肿最重要的临床表现,压迫症状一般在病程的晚期出现,但胸骨后甲状腺肿早期即可出现压迫症状。
(1)压迫气管:轻度气管受压通常无症状,受压较重可引起喘鸣、呼吸困难、咳嗽,开始在活动时出现,以后发展到静息时也出现。胸骨后甲状腺肿引起的喘鸣和呼吸困难常在夜间发生,可随体位改变而发生(如患者上肢上举)。当病人已有气道狭窄时,结节囊内出血或发生支气管炎可使呼吸困难症状急剧加重。
(2)压迫食管:食管位置较靠后,一般不易受压,如甲状腺肿向后生长,可压迫食管,引起
吞咽困难。
(3)压迫喉返神经:单侧喉返神经受压可引起声带
麻痹、声音嘶哑,双侧喉返神经受压还可引起呼吸困难。喉返神经受压症状可为一过性,也可为永久性。出现喉返神经受压症状,要高度警惕恶变可能。
(4)压迫血管:巨大甲状腺肿,尤其是胸骨后甲状腺肿可压迫颈静脉、锁骨下静脉甚至上腔静脉,引起面部水肿,颈部和上胸部浅静脉扩张。
(5)压迫膈神经:胸骨后甲状腺肿可压迫膈神经,引起呃逆,膈膨升。膈神经受压较少见。
(6)压迫颈交感神经链:胸骨后甲状腺肿可压迫颈交感神经链,引起Horners综合征。颈交感神经链受压较少见。
 治疗
治疗
治疗:对于多数散发性甲状腺肿病人,不论是弥漫性还是结节性,可以不需任何特殊治疗。
1.治疗指征 下列情况需要治疗:①有局部症状,从颈部不适到严重压迫症状;②影响美观;③甲状腺肿进展较快;④胸骨后甲状腺肿;⑤结节性甲状腺肿不能排除恶变者;⑥伴甲状腺功能异常者(包括临床及亚临床甲亢或甲减)。
2治疗原则 散发性甲状腺肿病人临床表现轻重不一,差异较大,因此,治疗方案应个体化,具体的治疗方法有
TSH抑制治疗、放射性碘治疗及手术治疗等。采用何种治疗方法,原则上应根据患者的病情决定。
3.不治疗、临床随访 许多散发性甲状腺肿病人甲状腺肿生长缓慢,局部无症状,甲状腺功能正常,可不予特殊治疗,临床密切随访,定期体检、B超检查,观察甲状腺肿生长情况,结节生长情况,必要时应做细针穿刺细胞学检查。另外,要定期检测血清
TSH水平,以及早发现亚临床甲亢或甲减。如有明显的致甲状腺肿因素存在,应予去除。
(1)一般评价:部分散发性甲状腺肿的发病机制与
TSH的刺激有关,用外源性甲状腺激素可以抑制内源性
TSH的分泌,从而防治甲状腺肿的生长,
TSH抑制治疗已被广泛应用于散发性甲状腺肿的治疗。
TSH抑制治疗前,应检测血清
TSH水平,若血清
TSH水平正常,则可进行
TSH抑制治疗,若血清
TSH<0.1mU/L,则提示有亚临床甲亢,不应行
TSH抑制治疗。
TSH抑制治疗时应检测血清
TSH水平或甲状腺摄
131I率(RAIU),一般认为血清
TSH<0.1mU/L或RAIU<5%为完全抑制,高于这水平为部分抑制。散发性甲状腺肿行
TSH抑制治疗时,血清
TSH水平应抑制到什么程度,目前尚无定论,一般认为,血清
TSH水平抑制到正常范围的下限水平即可。
(2)操作方法:年轻人开始口服L-T
4 100μg/d(T
4 80mg/d),以后逐渐增至L-T
4 150~200μg/d;老年人开始口服L-T
4 50μg/d(T
4 40mg/d),以后逐渐增加。根据血清
TSH水平调整L-T
4剂量,每2个月增加L-T
4 25μg/d,如果血清
TSH达到抑制水平6~12个月,甲状腺体积无明显缩小,应停用L-T
4。如甲状腺体积缩小,可尝试适当减少L-T
4的剂量而维持疗效,这种做法对于有心脏病或骨质疏松的老年人很重要。
TSH抑制治疗持续时间目前尚无定论,考虑到长期
TSH抑制治疗易引起房颤和骨质疏松,因此,L-T
4服药时间一般不超过2年,或者在甲状腺体积缩小后逐渐减少L-T
4的剂量。
TSH抑制治疗对于早期弥漫性、增生活跃的散发性甲状腺肿疗效较好,对于基础血清
TSH水平较高的病人疗效较好。一般治疗3~6个月后就能看到甲状腺体积明显缩小。L-T
4停用后易复发。
(3)
TSH抑制治疗的禁忌证:①亚临床甲亢;②不稳定心绞痛;③不规则房性心动过速。
①甲亢:外源性甲状腺激素,加上结节性甲状腺肿自主功能结节分泌的T3、T4,可引起临床或亚临床甲亢,甲亢可进一步引起心脏病变和骨病变。甲亢的发生与L-T4的剂量有关,减少L-T4剂量可使甲亢缓解或消失。
②心脏病变:长期血清
TSH水平抑制在0.1mU/L以下易引起心脏病变,如房颤、左心室肥大、心脏舒张功能下降。
③骨质疏松:绝经后妇女长期血清
TSH水平抑制在0.1mU/L以下可引起骨质吸收,骨质疏松,易发生骨折。
5.放射性碘(131I)治疗
(1)一般评价:放射性碘(131I)在毒性甲状腺肿的治疗中已广泛应用,在散发性非毒性甲状腺肿的治疗中尚未广泛应用。近年来情况有所改变,131I治疗散发性甲状腺肿已被越来越多的重视。近10年来,有多篇文献报告采用一次性大剂量131I治疗散发性甲状腺肿取得了较好的疗效,可使80%~100%病人甲状腺体积缩小40%~60%。Wesche(2001)报道,对放射性碘和L-T4治疗散发性非毒性甲状腺肿行前瞻性随机对照研究,发现单次剂量131I治疗2年后甲状腺体积缩小44%,而L-T4治疗2年后甲状腺体积缩小1%;131I治疗组97%的病人对治疗有反应(指甲状腺体积缩小≥13%),而L-T4治疗组仅43%的病人对治疗有反应;在对治疗有反应的患者中,131I治疗组甲状腺体积缩小46%,L-T4治疗组甲状腺体积缩小22%。Wesche的研究显示131I治疗散发性非毒性甲状腺肿的疗效明显优于L-T4。131I对散发性甲状腺肿甲状腺体积缩小的疗效与131I的剂量有相关性,与治疗前甲状腺的体积呈负相关。
对于门诊散发性甲状腺肿患者分次给予131I治疗也能取得较好的疗效。Howarth(1997)报道,对门诊较大结节性甲状腺肿患者分次给予131I,每个月给予555 MBq,共4个月,总量为2.22GBq(60mCi),结果71%患者主观感觉局部压迫症状改善,92%患者临床评估甲状腺体积缩小。分次给予131I的优点在于可以减轻单次大剂量给予131I可能造成的甲状腺水肿,对于伴有甲亢或者巨大胸骨后甲状腺肿患者较为有利。
(2)
1311治疗的适应证:①对于有手术指征但拒绝手术或有手术禁忌证者;②术后复发,再次手术并发症发生率较高,可采用
131I治疗;③伴临床或亚临床甲亢者;④绝经后或有心脏病者,由于
TSH抑制治疗可能会发生骨质疏松或心脏并发症;⑤年轻病人,传统上多采用
TSH抑制治疗,如采用
131I治疗可能达到更好的治疗效果,但
131I治疗后甲减的发生率较高。
(3)131I治疗的剂量:100μCi(3.7MBq)/g甲状腺组织(根据24h RAIU进行矫正)。
(4)131I治疗的禁忌证:①妊娠期妇女;②哺乳期妇女;③严重气管受压者。
(5)131I治疗的并发症:
①甲减:
131I治疗后最常见的并发症,Wesche报道,散发性甲状腺肿病人经
131I治疗2年后,甲减的发生率为45%;治疗前基础血清
TSH水平正常的病人,
131I治疗后易发生甲减;治疗前TPOAb阳性的病人
131I治疗后易发生甲减。
②放射性甲状腺炎:大剂量
131I治疗散发性甲状腺肿可出现放射性甲状腺炎,发生率约为3%~14%,在
131I治疗1个月内出现。表现为局部疼痛及甲亢症状,血清
TSHR抗体(TRAb)检测为阴性,3个月后恢复正常。
③Graves病:大剂量131I治疗散发性甲状腺肿可出现类似Graves病的甲亢,发生率约为5%,在131I治疗3个月后出现。血清TRAb升高,18个月后血清TRAb下降,治疗前血清TPOAb抗体升高的病人,131I治疗后易发生Graves病。
6.手术治疗 手术治疗可以迅速解除局部压迫症状,并能取得可靠的病理资料,因此,手术治疗散发性甲状腺肿具有不可替代的优势。
(1)手术适应证:①巨大甲状腺肿压迫气管、食管或喉返神经者;②胸骨后甲状腺肿;③巨大甲状腺肿影响生活、工作和美观者;④结节性甲状腺肿不能排除恶变者,包括单发结节、质硬结节、近期增长迅速的结节、
TSH抑制治疗过程中仍生长的结节、颈部X线检查示砂粒样钙化;⑤继发性甲亢;⑥弥漫性或结节性甲状腺肿,经内科治疗6~12个月,甲状腺肿大无明显缩小,甚至进一步增大者。
(2)手术禁忌证:①轻度地方性甲状腺肿患者;②儿童期、青春期、妊娠期患者; ③合并重要脏器严重器质性疾患者。
(3)手术方式及评价:手术方法需根据不同病情、甲状腺肿的大小、结节的情况等决定。常用的手术方式有甲状腺部分切除术、甲状腺叶次全切除术和甲状腺叶全切除术等。
①弥漫性甲状腺肿:一般采用甲状腺次全切除术(一叶或两叶)。
②单个结节为主的甲状腺肿:结节直径<3cm,可行腺叶部分切除术,切除范围应包括结节周围1cm后的正常甲状腺组织;结节直径≥3cm,应行腺叶次全切除术或腺叶全切除术。术中疑有恶变者,需行快速病理检查,如为恶性,则行全甲状腺或一叶全切除、对侧次全切除术。
③多结节性散发性甲状腺肿:行双侧甲状腺叶次全切除术或全甲状腺叶切除术、近全甲状腺切除术。目前,外科医师对多结节性甲状腺肿应采取何种手术方式争议较大。一种意见是应行甲状腺叶次全切除术,理由是甲状腺叶次全切除术时,术后并发症的发生率较甲状腺叶全切除术低。另一种意见是应行甲状腺叶全切除术,理由如下:
A.如果由有经验的甲状腺外科医师施行甲状腺叶全切除术,术后喉返神经损伤、甲状旁腺损伤的发生率很低,与甲状腺次全切除术相仿。
B.40%的结节分布在甲状腺叶背面部分,行甲状腺叶次全切除术无法完全切除病变,因此,术后复发率较高。
C.术后复发的病人再行手术,术后喉返神经损伤、甲状旁腺损伤的发生率要升高10倍左右。
D.不论是可触及的结节还是不能触及的结节,都有恶变的可能,两者恶变的几率差不多,约4%~6%,因此,甲状腺叶次全切除术有可能会遗漏潜在的恶变病灶。
④胸骨后甲状腺肿:胸骨后甲状腺肿的发生率很难确定,因为早期无症状的胸骨后甲状腺肿如不行X线检查很难发现,据文献报道,胸骨后甲状腺肿在行甲状腺切除术的病人中占2.6%~21%,文献报道差异较大可能与诊断标准不统一有关。胸骨后甲状腺肿绝大多数是颈部甲状腺肿的延续,只有很少一部分是真正的异位甲状腺肿。
手术应采用甲状腺叶全切除术,绝大多数可通过标准的颈部低领切口切除,少数需经胸骨劈开后切除。少数胸骨后甲状腺肿可延伸至后纵隔,则手术难度较大。
⑤术后复发:行残余甲状腺全切除,手术采用侧方入路,以便解剖及减少并发症。
(4)术后处理:甲状腺叶全切除术后应予小剂量L-T
4激素替代治疗;甲状腺叶次全切除术后应予较高剂量的L-T
4抑制治疗,较高剂量L-T
4抑制治疗不能完全预防术后复发,只能减少术后复发的几率。治疗期间应检测血清
TSH水平,前者维持血清
TSH水平在正常范围,后者抑制血清
TSH水平到正常范围的下限水平。
7.穿刺抽吸或注射无水酒精 对于囊性结节可行穿刺抽吸或注射无水酒精,也能起到使结节退缩的疗效。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
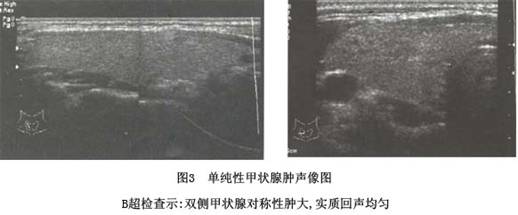
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防